Neurochemie des Gehirns: Gene, Neurotransmitter und Verhalten
Die in der Einleitung beschriebene Wirkung des Stresshormons Kortisol auf unser Erinnerungsvermögen ist ein eindrückliches Beispiel dafür, wie sehr körpereigene chemische Stoffe, also Hormone, aber auch Botenstoffe des Immunsystems und des Nervensystems (Neurotransmitter) auf kognitive Funktionen des Gehirns und damit auch auf unser Verhalten Einfluss nehmen können. In der folgenden, stark vereinfachenden Darstellung werden wir uns auf die Neurotransmitter beschränken. Einer kurzen Darstellung der Anatomie des Gehirns folgt eine kursorische Besprechung der Angriffspunkte und der Rollen einiger Neurotransmitter des Zentralnervensystems bei der Kontrolle von Hirnfunktion und menschlichem Verhalten.
Im Verlauf der Evolution der Hominiden zum Homo sapiens hat sich das Gewicht des Gehirns innerhalb von „nur“ etwa 2–3 Mio. Jahren fast verdreifacht.
- Betroffen von diesem enormen Wachstum ist vor allem die Neokortex genannte gefurchte Hirnrinde der beiden Hemisphären des Großhirns, die sich dem phylogenetisch älteren limbischen System – unserem „emotionalen Gehirn“ – und den in der Tiefe (im so genannten Marklager) gelegenen Basalganglien quasi wie ein Helm überstülpt.
- Das limbische System (von lat.: limbus, der Saum) umsäumt u. a. den Balken, der die beiden Hemisphären miteinander verbindet und sich über das Zwischenhirn und den darunter gelegenen Hirnstamm legt, der das Gehirn mit dem Rückenmark verbindet (s. Abb. 1.1).
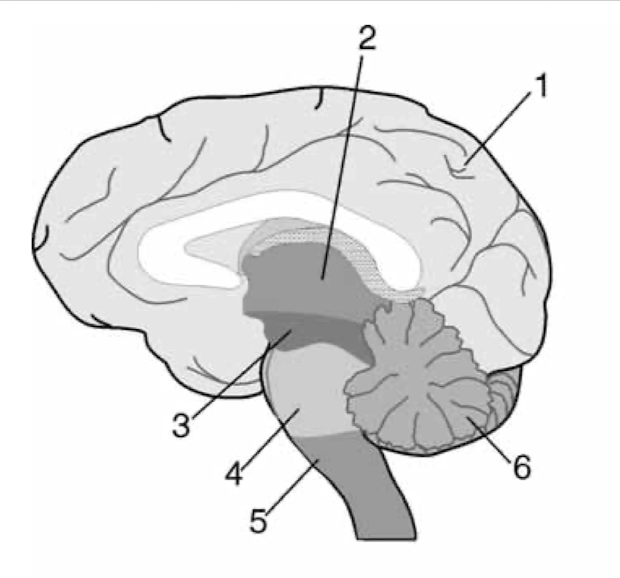 Abb. 1.1 Gliederung des Gehirns in seine Hauptabschnitte: 1. Telenzephalon (Vorderhirn oder Großhirn); 2. Dienzephalon (Zwischenhirn mit Thalamuskernen und Hypothalamus); 3. Mesenzephalon (Mittelhirn); 4. Pons (Brücke); 5. Medulla oblongata (verlängertes Rückenmark); 6. Zerebellum (Kleinhirn). Die linke und die rechte Hirnhemisphäre des Großhirns (hellgrau) sind durch den Balken (weiß) miteinander verbunden; sie werden außen von den Hirnhäuten umhüllt, in ihrem Inneren enthalten sie die mit Liquor gefüllte rechte und linke Hirnkammer (6) (nach Trepel).
Abb. 1.1 Gliederung des Gehirns in seine Hauptabschnitte: 1. Telenzephalon (Vorderhirn oder Großhirn); 2. Dienzephalon (Zwischenhirn mit Thalamuskernen und Hypothalamus); 3. Mesenzephalon (Mittelhirn); 4. Pons (Brücke); 5. Medulla oblongata (verlängertes Rückenmark); 6. Zerebellum (Kleinhirn). Die linke und die rechte Hirnhemisphäre des Großhirns (hellgrau) sind durch den Balken (weiß) miteinander verbunden; sie werden außen von den Hirnhäuten umhüllt, in ihrem Inneren enthalten sie die mit Liquor gefüllte rechte und linke Hirnkammer (6) (nach Trepel).
Zum Hirnstamm, einer entwicklungsgeschichtlich ganz ursprünglichen, vom Hirnforscher Paul McLean daher „Reptiliengehirn“ genannten Hirnregion, gehören das Mittelhirn, das Rautenhirn mit der „Brücke“ (Pons) zum Kleinhirn (Zerebellum) sowie das verlängerte Rückenmark (Medulla oblongata), das viele unserer vegetativen Funktionen reguliert, beispielsweise die Atmung und den Blutdruck.
Am Großhirn erkennt man vier Lappen, nämlich Stirn-, Scheitel-, Schläfen- und Hinterhauptlappen (Frontal-, Parietal-, Temporal- und Okzipitallappen), sowie zahlreiche Furchen (s. Abb. 1.2). Die Furchen unterteilen die Hirnoberfläche in Windungen (Gyri), z.B. in den vor der Zentralfurche gelegenen Gyrus praecentralis, der unsere Motorik beherrscht, oder den Gyrus cinguli (zinguläre Hirnrinde), der zusammen mit dem Mandelkern (Amygdala) zum limbischen System zählt.
In der grauen Substanz der nur wenige Millimeter dicken, gefurchten Hirnrinde (Cortex cerebri) befinden sich Milliarden von Nervenzellen, so genannte Neurone, die in mehreren Schichten übereinander liegen. Von jeder dieser Zellen sprießen zahlreiche Fortsätze (Dendriten), die – den Fangarmen eines winzigen Tintenfisches vergleichbar – unzählige Kontakte mit den Neuriten anderer Neurone knüpfen, bis zu 100 000 an der Zahl, und auf diese Weise Nervengeflechte, so genannte neurale Netzwerke bilden. An den Synapsen genannten Verknüpfungspunkten in den Nervengeflechten berühren sich die Fortsätze der Neuronen nur leicht; sie bleiben dabei nämlich immer noch durch eine submikroskopisch enge Kluft, den synaptischen Spalt, voneinander getrennt. Über diesen Spalt hinweg tauschen die Nervenzellen an den Synapsen mithilfe von Neurotransmittern Informationen aus. Sie „sprechen“ miteinander, indem jede Nervenzelle über die unzähligen Synapsen an ihren Fortsätzen an Tausende von Nervenzellen Nachrichten sendet und umgekehrt selbst wieder solche Signale empfängt, von denen sie entweder erregt oder in ihrer Aktivität gehemmt wird. Letztlich entscheidet dann die algebraische Summe aller empfangenen hemmenden bzw. erregenden Signale darüber, ob ein Neuron zum „Schweigen“ gebracht wird oder nicht. Auf diese Weise wird die Aktivität unseres Gehirns von den zahllosen Neurotransmittern bestimmt, welche die Billionen von erregenden oder hemmenden Synapsen der grauen Substanz durchfließen. Ein Übermaß, aber auch ein Mangel an einem ganz bestimmten Transmitter kann mithin zu mehr oder weniger schweren Störungen der Gehirnfunktion und des Verhaltens führen.
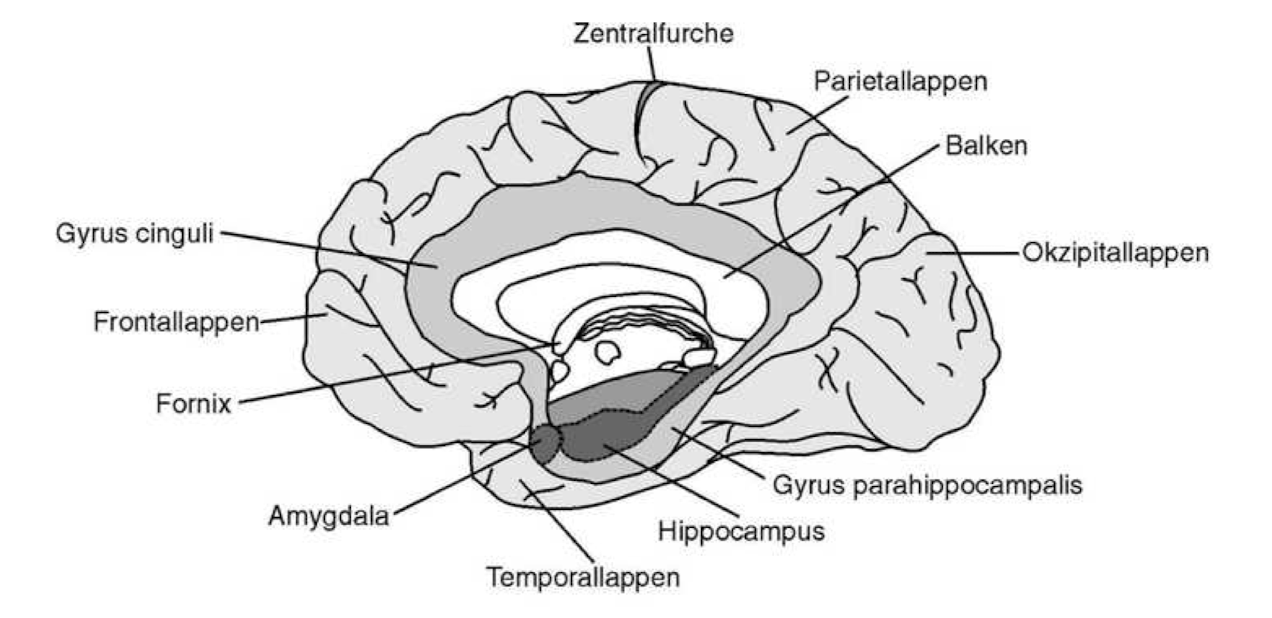
Abb. 1.2 Schematische Ansicht des Großhirns samt limbischem System. Das Großhirn gliedert sich in vier Lappen, nämlich Frontal-, Parietal-, Temporal- und Okzipitallappen. Der Fornix umsäumt das Zwischenhirn und verbindet den Hippocampus mit den Septumkernen und dem Hypothalamus, der untersten Partie des Zwischenhirns (hier verdeckt). Zum limbischen System rechnet man z.B. den zingulären Kortex (Gyrus cinguli), einen phylogenetisch alten Teil des Großhirns, sowie den Mandelkernkomplex (Amygdala) in der Tiefe des Temporallappens und den Gyrus parahippocampalis. Der Mandelkern ist reziprok mit dem orbitofrontalen Kortex im Frontallappen verschaltet, seiner wichtigsten Kontrollinstanz (nach Nieuwenhuys et al.).
Mit zunehmendem Alter wird man vergesslicher, was u. a. an einer verminderten Freisetzung des zerebralen Neurotransmitters Acetylcholin liegen könnte. Drastischer sind die Symptome der Parkinson-Krankheit (Paralysis agitans), die durch einen dramatischen Abfall des Gehaltes an Dopamin in den Basalganglien des Großhirns verursacht wird, oder beim so genannten „Parkinsonismus“ im Gefolge der epidemischen europäischen Schlafkrankheit (Encephalitis lethargica), die nach dem Ersten Weltkrieg jahrelang in ganz Europa grassierte.
Die nach ihrem Entdecker, dem Arzt James Parkinson (1755–1824) benannte Krankheit wird volkstümlich Schüttellähmung genannt, weil die Hände der Erkrankten ständig zittern. Die Kranken sind lethargisch, sie haben Mühe, eine Bewegung in Gang zu bringen, so als müssten sie gegen einen inneren Widerstand ankämpfen. Im fortgeschrittenen Stadium der Krankheit fehlt sogar jeder innere Antrieb zur Bewegung. Schließlich kommt es zur völligen Demenz. Als in den frühen 60er Jahren Mediziner und Neurowissenschaftler zum ersten Mal bei verstorbenen Kranken ein Defizit des Neurotransmitters Dopamin in den Basalganglien entdecken konnten, kamen sie auf die Idee, den Patienten das fehlende Dopamin zu ersetzen. Ihr Versuch schlug jedoch fehl, weil das verabreichte Dopamin zwar ins Blut gelangte, aber die Blut-Hirn-Schranke nicht passieren konnte. Daraufhin verabreichten die Ärzte das Medikament L-Dopa, welches über die Blutbahn bis ins Gehirn gelangt und dort mithilfe eines körpereigenen Biokatalysators – einem bestimmten Enzym namens Decarboxylase – unter Abspaltung von Kohlendioxid rasch in den Neurotransmitter Dopamin umgewandelt wird. Der Erfolg war schlagend; der Vorgang brachte den Patienten eine – leider meist nur temporäre –Erleichterung ihrer Beschwerden. In bewegenden Worten schildert Oliver Sacks in seinem Buch „Awakenings“ das Erwachen einer postenzephalitischen Patientin aus ihrer jahrzehntelangen Lethargie:
„Etwa eine halbe Stunde nach Einnahme der morgendlichen Dosis (ein g [L-Dopa]) sprang Mrs. Y. plötzlich auf und schritt vor den ungläubig dreinblickenden Mitpatientinnen den Flur der Station ab. (…) Mit der rechten Hand, die pötzlich aus ihrer jahrelangen Erstarrung befreit war, machte Mrs. Y. die ersten Eintragungen in ein Notizbuch. (…) Da ist nicht länger das Gefühl von ,ça ne marche pas‘ und innerer Sperre.“
Aber nicht nur der Überlebende der europäischen Schlafkrankheit, sondern auch beinahe jeder „echte“ Parkinson-Kranke zeigt, wenn er das „Wundermittel“ L-Dopa erhält, eine Art von „Erwachen“, folgert der Neuropsychologe Sacks aus seinen Studien an über 200 Parkinson-Patienten. Parkinson-ähnliche Symptome können auch durch gewisse Pharmaka und andere Drogen hervorgerufen werden, welche den Dopamingehalt in den Basalganglien herabsetzen (z.B. synthetische Heroinderivate), oder durch Stoffe, die den zellulären Angriffspunkt von Dopamin blockieren (wie die zur Bekämpfung der Schizophrenie eingesetzten Neuroleptika).
Die Entdeckung der Ursache der Symptomatik der Parkinson-Krankheit war ein Meilenstein in der Geschichte der Hirnforschung. Denn damit waren zum ersten Mal eine Gehirnerkrankung und Verhaltensstörung gefunden worden, deren Symptome durch ein Defizit eines Neurotransmitters verursacht werden – ein früher Triumph der Neurochemie. Erst viel später entdeckten die Neurowissenschaftler, dass auch andere Erkrankungen des Gehirns und der Psyche, wie z.B. die Schizophrenie oder die endogene Depression, durch eine Störung im Stoffwechsel von Neurotransmittern mit verursacht sind – vor allem von Aminosäurenabkömmlingen wie Dopamin, Noradrenalin und Serotonin. All diese Transmitter werden von „Projektionsneuronen“ gebildet, die ihren Urprung im Hirnstamm haben, aber mit ihren langen Axonen in andere Hirngebiete, etwa in die Basalganglien oder in den Frontallappen des Grosshirns, projizieren, Botenstoffe freisetzen und dadurch die Befindlichkeit und das Verhalten beeinflussen – manchmal auch krank machend.
Bereits in den 60er Jahren wurde vermutet, eine überschießende Verfügbarkeit von Dopamin könne Symptome der Schizophrenie auslösen. Denn Substanzen wie L-Dopa, welche die Bildung und Ausschüttung von Dopamin erhöhen und daher zur Bekämpfung der Parkinson-Erkrankung eingesetzt wurden, hatten nicht selten beängstigende Nebenwirkungen: Sie begünstigten die Entwicklung von Wahnvorstellungen, Halluzinationen und anderer schizophrener Symptome. Doch andererseits verschwanden bei Schizophrenen eben diese Symptome, wenn sie mit so genannten Neuroleptika behandelt wurden, mit Medikamenten also, die Dopamin von seinen zellulären Angriffspunkten verdrängen. Eine solche „ruhig stellende“ Dopamin-Blockade ist jedoch nicht unbedenklich, denn der Neurotransmitter entfaltet im Gehirn vielfältige physiologische Wirkungen – insbesondere auf die kognitiven Prozesse und die Motivation. Wir werden darauf noch zurückkommen.
Nach einer verbreiteten Lehrmeinung sind depressive Zustände auf einen Mangel an Serotonin im limbischen System zurückzuführen. Für die serotinerge Signalübermittlung im Gehirn ist zum einen die Freisetzung, zum anderen aber auch der Stoffwechsel dieses Neurotransmitters von großer Bedeutung. Denn die für die Neurotransmission durch Serotonin maßgebende Neurotransmitter-Konzentration im synaptischen Spalt hängt auch davon ab, wie effektiv das an den Nervenendigungen in die Synapsen freigesetzte Serotonin durch molekulare Serotoninpumpen (Eiweißmoleküle, so genannte Serotonin-Transporter) vom Ort des Wirkens entfernt und wieder in die Nervenendigungen „zurückgepumpt“ wird. Eine pharmakologische Hemmung von Serotonin-Transportermolekülen in den Synapsen sollte deshalb eine erhöhte lokale Serotoninkonzentration und somit eine verbesserte Signaltransmission in serotinergen Synapsen verursachen. Pharmakologische Hemmer der Serotoninpumpen (Reuptake-Hemmer), die zur Therapie von Depressionen eingesetzt werden, haben jedoch eine gefürchtete Nebenwirkung: Sie können Angstzustände auslösen, und zwar offenbar deshalb, weil sich zu viel Serotonin in den Synapsen anhäuft. Ganz besonders schwer können die Nachwirkungen der Partydroge „Ecstasy“ sein, welche geradezu eine „Serotoninüberschwemmung“ des Gehirns verursacht.
Nun geht ein Übermaß an Serotonin nicht nur auf den Gebrauch bestimmter Medikamente zurück – in einigen Fällen ist es auch erblich bedingt, dass dieser Neurotransmitter in zu großen Mengen im Gehirn vorhanden ist, etwa bei Neurasthenikern, bei denen infolge eines genetischen Defekts womöglich nicht genügend Serotonintransporterprotein gebildet wird. Nach den Untersuchungen von Lesch und Mitarbeitern besteht der fragliche vererbte molekulare Defekt in einer Veränderung des Gens, welches die Synthese der Transportermoleküle anleitet. Die DNS dieses Gens ist nämlich an einer entscheidenden Stelle (der so genannten Promoterregion) um 44 „Buchstaben“ (Basenpaare) der genetischen Schrift verkürzt und deshalb weniger wirksam, was dann eine verminderte Syntheserate des vom Gen programmierten Proteins zur Folge hat. Lesch und Mitarbeiter konnten an einem Kollektiv von über 500 Patienten den Nachweis erbringen, dass Träger des verkürzten Gens signifikant häufiger an Angstneurosen leiden als Menschen, bei denen das Gen nicht mutiert ist. Ängstlichkeit, die Prädisposition zur Angst und „Neurasthenie“ könnten demnach auch durch einen molekularen Defekt mit bedingt sein, der eine Störung im Stoffwechsel eines Neurotransmitters verursacht.
Genetisch bedingte Defekte im Stoffwechsel von Verhaltensstörungen verursachenden zerebralen Neurotransmittern sind nicht selten. So wurde, um noch ein weiteres Beispiel anzuführen, eine Mutation auf dem X-Chromosom entdeckt, die bei den Trägern des genetischen Defekts zu äußerst aggressiven Wutausbrüchen führt (s. Brunner et al.). Der Grund ist offenbar der durch den Gendefekt bedingte Mangel an einem bestimmten Enzym, der so genannten Monoaminoxidase, welche – durch einen oxidativen Prozess – normalerweise den Neurotransmitter Noradrenalin unschädlich macht, der im Gehirn in einem zu hohen Maß gebildet wird. Fehlt aber das Enzym, so reichert sich das Monoamin Noradrenalin an; schon der geringste Stress kann deshalb nicht nur Adrenalinstösse, sondern geradezu ein zerebrales „Adrenalingewitter“ auslösen, das – nicht überraschend – dann die aggressiven Wutanfälle bewirkt. (Dass Kampfgeist und Aggressivität vererbt sein können, wusste man allerdings schon lange – beispielsweise in Andalusien, wo seit Jahrhunderten frei lebende Stiere für den Kampf in den spanischen Arenen herangezüchtet werden.)
Versuchen wir nun, das Gesagte auf den Punkt zu bringen: Ein Übermass, aber auch ein Mangel an gewissen Neurotransmittern des Gehirns kann dramatische Störungen im menschlichen Verhalten und in der Befindlichkeit verursachen. Häufig werden diese biochemischen Veränderungen im Zentralnervensystem durch die Fehlfunktion eines ganz bestimmten Eiweißkörpers ausgelöst, dessen richtige Herstellung durch ein einziges mutiertes, krank machendes Gen verhindert wird – ganz so, wie es das OGOD-Prinzip der Molekularen Medizin beschreibt (OGOD = One Gene, One Disease). Die Entdeckung dieses Prinzips geht auf den berühmten Chemiker und Nobelpreisträger Linus Pauling zurück, der auch den Begriff „Molekulare Krankheit“ prägte. Dennoch: Die großen Erfolge einer solchermaßen reduktionistischen Molekularen Medizin müssen relativiert werden und sollten uns Folgendes nicht vergessen lassen:
- Die Durchschlagskraft (Penetranz) eines krank machenden Gens ist ganz selten hundertprozentig – im Falle von Schizophrenie und bipolarer Depression beträgt sie sogar „nur“ etwa 50% –, weil sie meist von modulierenden Genen und so genannten „epigenetischen“ Faktoren mit beeinflusst wird.
- Bei allen molekularen Krankheiten ist immer auch der ganze Mensch in seinem Verhalten und in seiner Befindlichkeit betroffen, und wie dies mit dem molekularen Defekt zusammenhängt, weiß man in den allermeisten Fällen leider noch immer nicht.
Wieso sind beispielsweise Kinder mit einem Gendefekt, der ein ganz bestimmtes Enzym des Purinstoffwechsels betrifft, geistig retardiert, und warum haben diese jungen Menschen, die am so genannten Lesch-Nyhan-Syndrom leiden, die unbezwingbare Neigung, sich selbst zu verstümmeln? Um sich solchen Problemen zu nähern, müssen auch neurophysiologische, neuroanatomische und verhaltensbezogene Fragen formuliert werden, die letztlich nur durch Untersuchungen am ganzen Menschen experimentell angegangen werden können. Das Wissen um die molekulargenetischen und biochemischen Vorgänge ist zwar hilfreich und notwendig, aber meist bei weitem nicht ausreichend für das Verständnis der Pathogenese und der Krankheitssymptome – insbesondere, wenn es um psychosomatische Erkrankungen geht, die ja bekanntermaßen auch stark durch die Umwelt beeinflusst werden.
Therapieansätze mittels Hypnosetherapie
Hier sind detaillierte Informationen zu den neurobiologischen und psychosomatischen Therapieansätzen der Hypnosetherapie, insbesondere im Kontext der Neurochemie des Gehirns, der Rolle von Neurotransmittern und deren Einfluss auf Verhalten:
Neurobiologische Ansätze der Hypnosetherapie
1. Neurotransmitter und deren Einfluss
Dopamin: Hypnosetherapie kann die Dopaminaktivität im Gehirn modulieren. Ein Ungleichgewicht in Dopamin wird mit Erkrankungen wie Schizophrenie und Parkinson in Verbindung gebracht. Durch Hypnose können positive Suggestionen gegeben werden, die helfen, die Dopaminproduktion zu regulieren, was zu einer Verbesserung der Stimmung und der Motivation führen kann.
Serotonin: Diese Neurotransmitter sind entscheidend für die Regulierung von Stimmung und Angst. Hypnose kann helfen, die Serotoninfreisetzung zu steigern, was bei der Behandlung von Depressionen und Angststörungen von Vorteil ist. Eine erhöhte Serotoninaktivität kann das allgemeine Wohlbefinden fördern und Angstzustände reduzieren.
Noradrenalin: Dieser Neurotransmitter spielt eine Rolle bei der Stressreaktion. Hypnose kann dazu beitragen, die Noradrenalinausschüttung zu regulieren, was zu einer Verringerung von Stress und Angst führt. Dies ist besonders wichtig, da chronischer Stress negative Auswirkungen auf die Gesundheit hat.
2. Stressreduktion und Kortisol
Kortisol: Dieses Stresshormon hat einen direkten Einfluss auf das Gedächtnis und das emotionale Wohlbefinden. Hypnose kann helfen, die Kortisolproduktion zu senken, was die Gedächtnisleistung verbessern und die Auswirkungen von Stress auf den Körper verringern kann. Studien zeigen, dass Hypnose bei der Bewältigung von Stress und der damit verbundenen Symptome effektiv ist.
3. Neuroplastizität
Hypnosetherapie kann neuronale Umstrukturierungen bewirken. Diese Veränderungen im Gehirn können dazu führen, dass Klienten besser auf Stress reagieren und ihre emotionalen Reaktionen anpassen können. Die Fähigkeit des Gehirns, sich durch Erfahrungen zu verändern, ist ein zentraler Aspekt der Neuroplastizität.
Psychosomatische Ansätze der Hypnosetherapie
1. Emotionale Verarbeitung
Hypnose ermöglicht es Klienten, tiefere emotionale Konflikte zu erkennen und zu verarbeiten. Viele psychosomatische Erkrankungen sind das Ergebnis von unverarbeiteten Emotionen. Durch Hypnose können Klienten diese Emotionen adressieren und somit ihre körperlichen Symptome lindern.
2. Selbstheilungskräfte aktivieren
Hypnosetherapie fördert die Aktivierung der Selbstheilungskräfte des Körpers. In einem hypnotischen Zustand sind Klienten empfänglicher für positive Suggestionen, die ihre Gesundheit und ihr Wohlbefinden steigern können.
3. Verhaltensänderung
Hypnose kann helfen, dysfunktionale Verhaltensmuster zu identifizieren und zu ändern. Dies ist besonders hilfreich bei der Behandlung von Suchtverhalten, Angstzuständen oder Phobien. Durch gezielte Suggestionen können Klienten lernen, ihre Reaktionen auf bestimmte Auslöser zu modifizieren.
4. Umgang mit Ängsten
Hypnose hat sich als wirksam bei der Behandlung von Ängsten und Phobien erwiesen. Die ursachenorientierte Methode wird häufig verwendet, um Klienten zu helfen, ihre Ängste zu bewältigen und Kontrolle über ihr Verhalten zurückzugewinnen.
Anwendung in der Praxis
Individuelle Therapieansätze: Hypnosetherapeuten passen die Behandlung an die spezifischen Bedürfnisse der Klienten an, wobei sowohl psychische als auch physische Symptome behandelt werden.
Kombination mit anderen Therapien: Hypnosetherapie wird oft in Kombination mit anderen therapeutischen Ansätzen eingesetzt, um die Wirksamkeit zu erhöhen.
Insgesamt zeigt die Hypnosetherapie vielversprechende Ergebnisse in der Behandlung neurochemischer und psychosomatischer Störungen und wird zunehmend als integrativer Bestandteil von ganzheitlichen Behandlungen anerkannt.
Rüegg, Johann Caspar. Gehirn, Psyche und Körper: Neurobiologie von Psychosomatik und Psychotherapie.